|
| Fluxul de Stiri dupa Data Aparitiei |
|
Comentarii Adauga Comentariu _ Poarta neuronală către moleculele esențiale în învățare și memorie descoperită la scară atomică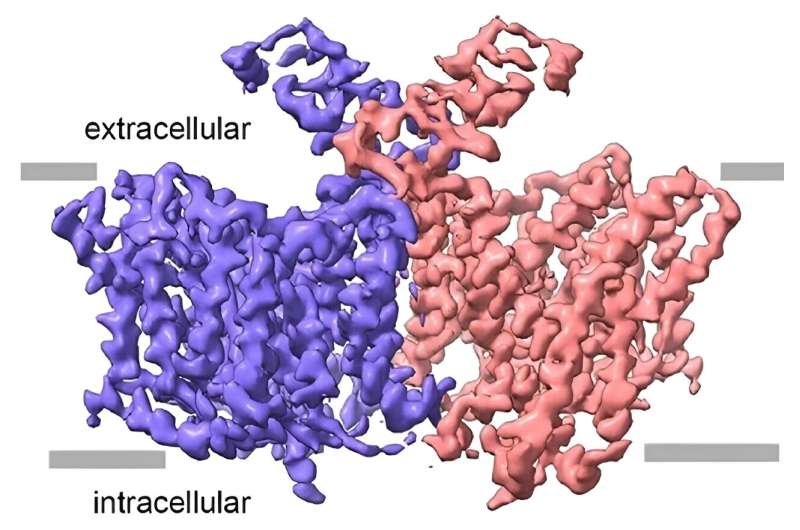 _ Poarta neuronală către esențial molecule în învățare și memorie descoperite la scară atomicăÎnvățarea dintr-o experiență, amintirea unei anecdote sau schimbarea unei atitudini sunt exemple care dezvăluie modul în care tot comportamentul nostru este rezultatul schimbului de compuși chimici – neurotransmițători – între neuroni . Dezvăluirea a ceea ce se întâmplă exact la nivel molecular atunci când neuronii „vorbesc” între ei la sinapse este crucială pentru înțelegerea creierului uman în general și, în special, pentru a ajuta la rezolvarea problemelor de sănătate mintală. Acum, un Studiul a observat și descris structura unei proteine din membrana neuronilor care acționează ca o poartă care se deschide și se închide. Este proteina Asc1/CD98hc (Asc1), care acționează ca un transportor specific pentru anumiți aminoacizi cheie pentru învățare și memorie. Articolul, publicat în revista Nature Communications, a fost condus de echipe de la Universitatea din Barcelona (UB), Institutul de Cercetare în Biomedicină (IRB Barcelona), Centrul Național Spaniol de Cercetare a Cancerului (CNIO) și Centrul de Cercetare Biomedicală de Rețea pentru Boli Rare (CIBERER). Activitatea Proteina Asc1 a fost legată de diferite tipuri de patologii mentale. Prin urmare, înțelegerea structurii sale tridimensionale va permite dezvoltarea de noi medicamente pentru aceste patologii. „Modularea activității Asc1 ar putea fi o strategie terapeutică pentru afecțiuni precum accidentul vascular cerebral și schizofrenia. Determinarea structurii Asc1 la nivel atomic. rezoluția este importantă deoarece poate ajuta la căutarea compușilor care îi modifică activitatea”, spune expertul Óscar Llorca (CNIO). „Colaborarea dintre UB, IRB Barcelona și CNIO a fost cheia pentru dezlegare. misterele Asc1 și obținerea unei perspective fără precedent asupra structurii și funcției sale Descoperirea nu numai că aruncă lumină asupra mecanismelor celulare complexe care stau la baza proceselor cognitive fundamentale, dar ne aduce și mai aproape de dezvoltarea unor intervenții terapeutice mai precise pentru o serie de tulburări neurologice. „, adaugă Manuel Palacín, lector la Departamentul de Biochimie și Biomedicină Moleculară a Facultății de Biologie a UB și șeful Laboratorului Transportatorilor de Aminoacizi și Bolilor de la IRB Barcelona. Pe lângă experții Óscar Llorca și Manuel Palacín, Ekaitz Errasti-Murugarren, profesor la Departamentul de Științe Fiziologice de la Facultatea de Medicină și Științe ale Sănătății a UB, a participat și el la studiu. Primii autori sunt Josep Rullo-Tubau (IRB Barcelona) și María Martínez-Molledo (CNIO). Fiecare celulă din organism are porți în membrana sa pentru schimbul de substanțe cu mediul exterior. Acestea sunt proteine care se deschid și se închid continuu în funcție de nevoile celulei. Mai exact, ele se deschid spre interior, captează molecule – de exemplu, un aminoacid – cu o modificare a structurii lor, le eliberează și se deschid spre exterior, sau invers. Proteina Asc1 se găsește în principal în neuronii hipocampul și cortexul cerebral din creier. Este specializată în mutarea a doi aminoacizi cheie - și anume D-serină și glicină - în sau în afara neuronului pentru conexiunile neuronale - sinapsele - implicate în învățare, memorie și plasticitatea creierului, care este capacitatea sistemului nervos de a modifica circuitele. ca răspuns la noile medii. Fluctuațiile în furnizarea acestor aminoacizi au fost legate de schizofrenie, accident vascular cerebral, SLA și alte boli neurologice. Au existat de mult timp încercări de a proiecta medicamente care reglează activitatea Asc1 pentru a trata aceste boli, dar fără succes. O înțelegere detaliată a structurii atomice a Asc1 oferă informații esențiale pentru a realiza acest lucru. Proteina Asc1 a fost purificată de expertul Josep Rullo-Tubau de la IRB Barcelona și transferată la CNIO, astfel încât María Martínez-Molledo să o poată observa cu microscopie crioelectronică și, astfel, să determine structura Asc1 în 3D și rezoluție înaltă folosind aceste imagini. Cu tehnica microscopiei crioelectronice, moleculele sunt înghețate la viteză mare și observate la microscoape electronice. Tehnici avansate de imagistică sunt apoi folosite pentru a interpreta informațiile. Structura observată arată Asc1 când a fost prins într-un stadiu în care poarta era deschisă spre interiorul celulei, exact când aștepta să primească un aminoacid care trebuie transportat. „Din structura sa atomică, am putut prezice ce părți ale proteinei par importante pentru legarea aminoacidului care urmează să fie transportat și posibilul mecanism de transport al acestuia din celulă”, spune Llorca. Grupurile experților Víctor Guallar (Barcelona Supercomputing Center) și Lucía Díaz (Nostrum Biodiscovery) au făcut aceste predicții despre funcționarea transportorului, care au fost testate de Rullo-Tubau prin măsurarea efectului mutațiilor specifice în Asc1. Acest studiu a fost completat de Rafael Artuch (Hospital Sant Joan de Déu) și platforma științifică de biostatistică și bioinformatică de la IRB Barcelona, condusă de Camille Stephan-Otto Attolini. Descoperirile ajută la explicarea unei alte particularități a Asc1. În timp ce restul familiei de transportatori căreia îi aparține – numiți HAT – pot schimba doar aminoacizi – adică transporta un aminoacid în celulă atunci când scot un altul sau invers – Asc1 poate elimina un aminoacid fără nevoia de a introduce un altul, și de a deschide și închide în vid. Acest mod de transport se numește difuzie. Rezultatele obținute asupra structurii moleculare a Asc1 oferă date pentru a înțelege mai bine funcția îndeplinită de fiecare dintre modurile de transport.
Linkul direct catre PetitieCitiți și cele mai căutate articole de pe Fluierul:
|
|
|
Comentarii:
Adauga Comentariu