|
| Fluxul de Stiri dupa Data Aparitiei |
|
Comentarii Adauga Comentariu _ Sondarea pomparii protonilor: noi descoperiri privind plierea proteinelor in bacteriorhodopsin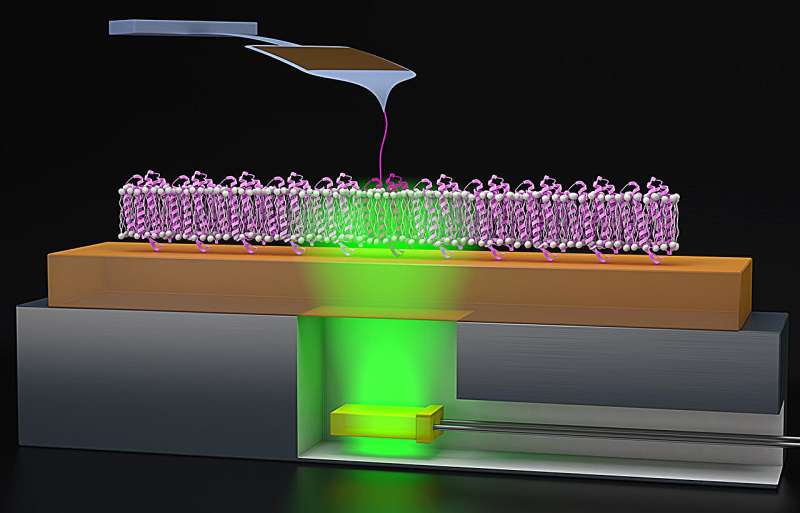 _ Probing proton pumping: noi descoperiri privind plierea proteinelor în bacteriorhodopsinCând vine vorba de dezvoltarea medicamentelor, proteinele membranare joacă un rol crucial, aproximativ 50% dintre medicamente vizează aceste molecule. Înțelegerea funcției acestor proteine membranare, care se conectează la membranele celulelor, este importantă pentru proiectarea următoarei linii de medicamente puternice. Pentru a face acest lucru, oamenii de știință studiază proteine model, cum ar fi bacteriorhodopsin (bR), care, atunci când sunt declanșate de lumină, pompează protoni peste membrana celulelor. În timp ce bR a fost studiat timp de o jumătate de secol, fizicienii au studiat Tehnicile dezvoltate recent pentru a observa mecanismele sale de pliere și energia în mediul nativ al membranei bistraturi lipidice a celulei. Într-un nou studiu publicat de Proceedings of the National Academy of Sciences (PNAS), JILA Fellow Thomas Perkins și echipa sa a avansat aceste metode combinând microscopia de forță atomică (AFM), un instrument convențional de măsurare a nanoștiinței, cu declanșatoare de lumină cronometrate precis pentru a studia funcționalitatea funcției proteinei în timp real. „Energia membranei proteinele a fost dificil de studiat și, prin urmare, nu a fost bine înțeles”, a explicat Perkins. „Folosind AFM și alte metode, putem crea modalități de a analiza mai departe acest lucru”. Înarmați cu o mai bună înțelegere a energiei acestor proteine, chimiștii pot proiecta medicamente care sunt mai puternice pentru simptome și boli specifice cauzate de funcționarea defectuoasă a proteinelor. În timp ce bR este o proteină microscopică, poate fi văzută de către cu ochiul liber și chiar și în imaginile din satelit, când microorganismele arheonice înfloresc, ele lasă cantități mari din el ca reziduuri în iazurile cu apă sărată. „Iazurile se umplu cu ceea ce se numește Halobacterium salinarum, organismul părinte al bacteriorhodopsinei”, a spus Perkins. „Aceste iazuri sunt folosite pentru a recolta sare și, pentru că sunt calde și sărate, bacteriilor le place să crească acolo.” La nivel microscopic, bR lucrează cu alte proteine membranare pentru a produce energie pentru celulă. prin crearea unui gradient de protoni pe o parte a membranei celulare, care duce protonul spre cealaltă parte a membranei. bR face acest lucru prin plierea și desfășurarea elicelor sale în forme specifice pentru a controla câți protoni trec prin membrană. În timpul acestui proces, migrarea protonilor produce energie chimică sub formă de adenozin-trifosfat (ATP). Pentru Perkins și co-autorul său David Jacobson (fost cercetător postdoctoral JILA și acum profesor asistent). de la Universitatea Clemson), bR a prezentat o oportunitate de a proiecta o nouă metodă experimentală pentru analiza energetică funcțională în timp real. Pentru a studia proteine precum bR, Jacobson și Perkins utilizează AFM, care acționează ca un deget mic pentru a trageți ușor de proteină, ceea ce ajută AFM să simtă suprafața proteinei, cartografiind structura acesteia și oferind o mai bună înțelegere a modului în care proteina se pliază. Deoarece procesele de pliere ale bR sunt declanșate de lumină, Perkins și Jacobson a adăugat un element de iluminat la procedura AFM. „Am avut această idee inteligentă de a lipi LED-uri verzi super subțiri – care declanșează bacteriorhodopsina – pe un disc de metal, pe care îl putem atașa la AFM”, a spus Perkins. „Aceste LED-uri verzi sunt, de asemenea, ieftine, cum ar fi 1,00 USD bucata sau 1,50 USD bucata. În comparație cu cantileverul nostru AFM, care costă aproximativ 80 USD bucata, aruncarea unui LED de 1,50 USD nu este ceva pentru care ne facem griji.” Cu acest ieftin. suplimentul la AFM, Perkins și Jacobson ar putea determina bR să se plieze și să se dezvolte cu precizie de milisecunde. După ce și-au colectat datele, cercetătorii au descoperit că proteina s-a pliat corect în 60% din timp, permițând protonilor să treacă prin membrană. Pentru a verifica funcția energetică și în timp real a plierii proteinei, oamenii de știință au mutat proteina bR pentru a rămâne întotdeauna în starea „deschisă” sau nepliată. Folosind noua lor configurație experimentală, ei ar putea reproduce descoperiri similare cu cele observate înainte în faza „deschisă” a fotociclului bR. „În biologie, s-ar putea să vezi ceva, dar trebuie să întrebi, am Văd ceea ce cred că văd?" spuse Perkins. „Așadar, făcând o mutație și văzând efectul pe care ne-am așteptat, am crescut încrederea că studiem cu adevărat procesul pe care credem că îl studiem.” În timp ce Perkins și Jacobson au observat o pliere corectă de 60% din timp, celelalte 40% din cazuri i-au surprins, deoarece proteina s-a pliat greșit, dar putea încă pompa un proton prin membrană. „Deplierea greșită se stabilizează de fapt”, a adăugat Perkins. „Și asta a fost cu adevărat surprinzător”. În multe cazuri, plierea greșită a proteinei nu are ca rezultat stabilizare. Datorită stabilizării energetice, Perkins și Jacobson au teoretizat că elicele structurale ale bR nu se separau corespunzător pentru a oferi un tunel complet deschis pentru proton, deși a continuat să treacă, un proces greu de detectat cu imagistica AFM. Încercând să înțeleagă mai bine mecanismele care stau la baza plierii greșite, Perkins și Jacobson au redus forța asupra testului de tragere AFM la zero pentru a vedea dacă acest lucru ar fi convinge proteina să se plieze corect. Cu toate acestea, rezultatele au rămas aceleași: 40% din cazuri au dus la pliere greșită. Aceste rezultate, cu aceeași cantitate de pliere greșită, i-au nedumerit pe cercetători. Deși Perkins și Jacobson nu au putut identifica cauza acestor cazuri greșite, ei speră să investigheze în continuare. Acum, ei sunt interesați să vadă ce face restul comunității de biofizică din aceste rezultate. „Ar putea exista efecte mai subtile, sau poate o știință nouă acolo”, a adăugat Perkins. „S-ar putea să existe o cale pe care poate oamenii nu au reușit să o vadă înainte.”
Linkul direct catre PetitieCitiți și cele mai căutate articole de pe Fluierul:
|
|
|
Comentarii:
Adauga Comentariu