|
| Fluxul de Stiri dupa Data Aparitiei |
|
Comentarii Adauga Comentariu _ Oamenii de știință dezvăluie modul în care SID-1 recunoaște dsARN și inițiază interferența sistemică a ARN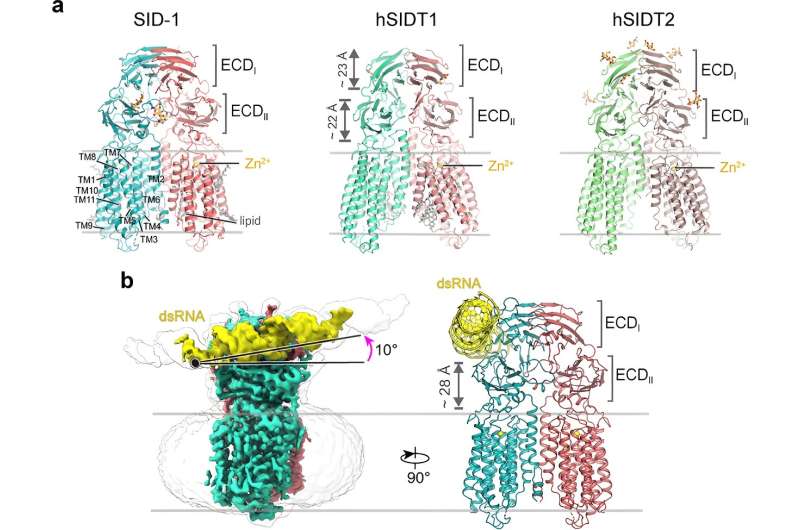 _ Oamenii de știință dezvăluie modul în care SID -1 recunoaște dsARN și inițiază interferența sistemică a ARNInterferența ARN (ARNi) este un proces biologic fascinant în viermi, plante, ciuperci și metazoare, care a fost un instrument valoros pentru studierea funcției genelor și ca terapie. În Caenorhabditis elegans, proteina transmembranară multipass, proteina sistemică 1 defectuoasă a interferenței ARN (SID-1), joacă un rol indispensabil în absorbția și livrarea ARN-ului dublu catenar (dsRNA) între celule și țesuturi, conducând la ARNi sistemic. În plus, doi omologi umani SID-1, membrul 1 al familiei transmembranare SID1 (SIDT1) și SIDT2, au fost implicați în transportul ARN. Cu toate acestea, mecanismele moleculare care stau la baza modului în care SID-1 distinge în mod specific dsARN de ARN monocatenar (ssRNA) și ADN și facilitează transportul ulterior de dsARN între celule rămân necunoscute. Răspunsurile la aceste întrebări sunt importante pentru înțelegerea sistemică. ARNi și pentru a ajuta în aplicații legate de ARN. Dr. Zhang Jiangtao din grupul prof. Jiang Daohua de la Institutul de Fizică al Academiei Chineze de Științe, a demonstrat cum SID-1 recunoaște în mod specific dsARN și a oferit perspective importante asupra internalizării dsARN de către SID-1 prin combinarea crio-EM, in vitro și experimente in vivo. Lucrarea este publicată în revista Nature Structural & Molecular Biology. Timp de mai bine de două decenii, SID-1 a fost considerat că funcționează ca un canal dsARN. Aici, cercetătorii au rezolvat structuri crio-EM de înaltă rezoluție ale SID-1 și omologii umani SID-1 SIDT1 și SIDT2, dezvăluind arhitectura conservată a C. elegans și omologii umani SID-1. The Omologii SID-1 sunt organizați într-o manieră homo-dimerică. În mod surprinzător, dimerul SID-1 nu prezintă un por evident în domeniul transmembranar, sugerând că SID-1 poate să nu funcționeze ca un canal dsARN. Testele de legare MST au confirmat că SID-1 se poate lega puternic și specific la dsARN, dar nu și la dsDNA. Ulterior, cercetătorii au obținut structura crio-EM a complexului SID-1-dsARN, demonstrând ARNdb detaliat. modul de legare și determinanții moleculari ai modului în care SID-1 distinge dsARN de ssRNA și ADN. Interesant, astfel de determinanți nu sunt prezenți în SIDT1 sau SIDT2 uman. Descoperirile structurale au fost susținute de studii de mutageneză folosind teste de legare a MST, captarea dsARN în celulele S2 și teste sistemice ARNi in vivo. În cele din urmă, cercetătorii arată că îndepărtarea elicelor transmembranare lungi de buclă intracelulară 1 și 2 nu a afectat dimerizarea SID-1, localizarea celulelor sau legarea dsARN, dar a afectat semnificativ absorbția dsARN în celulele S2 și ARNi sistemic în C. elegans. În plus, co-localizarea a relevat faptul că SID-1 și ARNds se co-localizează în organele subcelulare asemănătoare veziculelor. Pe baza acestor rezultate, cercetătorii propun că SID-1 funcționează ca un receptor dsARN și facilitează internalizarea ulterioară a dsARN prin recrutarea proteinelor legate de endocitare prin bucla lungă.
Linkul direct catre PetitieCitiți și cele mai căutate articole de pe Fluierul:
|
|
|
Comentarii:
Adauga Comentariu