|
| Fluxul de Stiri dupa Data Aparitiei |
|
Comentarii Adauga Comentariu _ Oamenii de știință generează un nou sistem țintit de degradare a proteinelor care reglează proteinele proprii ale celulei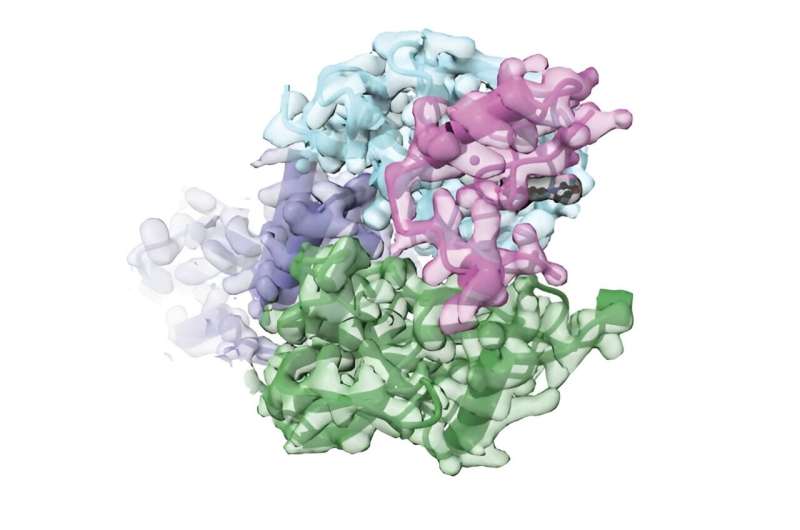 _ Oamenii de știință generează o nouă degradare țintită a proteinelor sistem care reglează proteinele proprii ale unei celuleCercetătorii care studiază rolul proteinelor în sănătate și boli folosesc instrumente experimentale care inactivează proteinele, le distrug sau împiedică producerea lor în celule. Într-o abordare, ei marchează proteinele vizate cu etichete „distruge-mă” care funcționează cu molecule mici cunoscute sub numele de cleiuri moleculare pentru a determina propriile mașini de curățare a proteinelor din celule să înghită proteinele. Cu toate acestea, multe etichete folosite astăzi sunt prea mari pentru a marca genele care codifică proteinele native ale unei celule sau provoacă daune colaterale, provocând distrugerea proteinelor dincolo de cea vizată. Acum, oamenii de știință de la Broad Institute of MIT și Harvard au folosit o platformă de evoluție continuă numită PACE pentru a genera etichete mai mici de degradare a proteinelor, sau degroni, care formează complexe de lipici moleculari capabili să declanșeze cu precizie epuizarea proteinelor proprii ale unei celule. Echipa a folosit apoi o genă. -tehnologia de editare pe care au dezvoltat-o anterior numită editare primară pentru a introduce degronul compact în genomul celulelor umane, unde a recrutat cereblonul, o componentă cheie a căii de distrugere a proteinelor celulare, în prezența unei molecule mici, altfel inerte, pentru a induce rapid degradarea proteinelor. Oamenii de știință au rezolvat structura 3D a complexului cu trei componente și au dezvăluit perspective asupra activității și specificității sale și, de asemenea, au dezvoltat variante de degron care funcționează în celulele de șoarece. Platforma are potențialul de a dezvolta noi degroni și complexe moleculare de lipici care ar putea fi utilizate pentru a explora funcția proteinelor sau pentru a valida ținte terapeutice. Studiul apare în Science. „Am arătat că evoluția continuă este o abordare puternică pentru a evolua rapid sistemele de lipici moleculari care pot deveni instrumente utile de cercetare”, a spus David Liu, autor principal al studiului și Richard. Profesor Merkin și director al Institutului Merkin de Tehnologii Transformative în Sănătate de la Broad. „Suntem încântați să vedem cum abordarea poate fi aplicată și pentru a dezvolta alte proteine care interacționează cu molecule mici în mod creativ și moduri puternice.” Liu este, de asemenea, investigator al Institutului Medical Howard Hughes și profesor la Universitatea Harvard. Efortul se bazează pe lucrările publicate la începutul acestui an și conduse de coautorul principal Amit Choudhary, membru asociat al Broad și un profesor asistent de medicină la Harvard Medical School. Acest studiu a identificat o serie de molecule legate de talidomidă, un adeziv molecular clasic care interacționează cu cereblonul pentru a declanșa degradarea proteinelor și este folosit pentru a trata unele tipuri de cancer și afecțiuni ale pielii. În timp ce talidomida declanșează distrugerea numeroaselor proteine, o moleculă înrudită cunoscută sub numele de PT-179 a fost relativ inertă, ceea ce o face un bun punct de plecare pentru un sistem de lipici molecular mai precis. În noul studiu, cercetătorii au folosit un sistem numit evoluție continuă asistată de fagi (PACE), dezvoltat pentru prima dată în laboratorul lui Liu de la Harvard în 2011, pentru a genera un degron care ar putea funcționa cu PT-179. PACE le permite cercetătorilor să dezvolte rapid noi proteine care au caracteristici utile. În experimentele conduse de primii autori Jaron Mercer și Stephan DeCarlo, echipa a început cu un motiv cu degetul de zinc, un element structural proteic cunoscut pentru a se implica. cereblon legat de lipici molecular. Prin sute de generații de evoluție în timpul PACE, ei au dezvoltat noi domenii degete de zinc care interacționează cu cereblon atunci când sunt legate de lipiciul molecular PT-179. Cercetătorii au redus apoi domeniul degetelor de zinc la doar 36 de aminoacizi. , numit SD40. „Am vrut să găsim cel mai mic motiv posibil, astfel încât să putem folosi tehnologia noastră de editare principală pentru a marca eficient genele endogene din genom”, a spus DeCarlo, un student absolvent la Universitatea Harvard și cercetător în laboratorul Liu. „Este un mare obiectiv în biologie acela de a studia pierderile de proteine sub control de reglementare endogen, nu numai pentru validarea țintelor medicamentului, ci și pentru studierea funcției proteinelor native în biologie.” Ei apoi a folosit prima editare pentru a introduce SD40 în genomul celulelor umane și a marca două proteine diferite. Proteinele vizate au început să dispară din celulă la doar câteva minute după adăugarea PT-179, fără niciun efect observat asupra vreuneia dintre miile de proteine nețintite evaluate. „Alte sisteme au arătat degradarea unei proteine care este străină de celula, dar folosind această etichetă puternică pe care am evoluat, am arătat degradarea proteinelor țintă native din acea celulă, ceea ce este mai semnificativ din punct de vedere biologic”, a spus Mercer, un post-doctorat în laboratorul Liu. Pentru un Privind în profunzime modul în care SD40, cereblonul și PT-179 interacționează, echipa a analizat structura tridimensională a complexului printr-o activitate condusă de co-primul autor Shourya Roy Burman, un coleg de cercetare în laboratorul coautorului principal și cereblon. expert Eric Fischer de la Dana-Farber Cancer Institute. Folosind microscopia crio-electronică, echipa a arătat că atunci când este legat de SD40 și PT-179, cereblonul este într-o conformație închisă, SD40 părând să țină receptorul. două capete împreună. Lucrarea sugerează că cereblonul poate avea nevoie să fie „închis” pentru a transmite mesajul către alte proteine din complex pentru a semnala proteina vizată pentru distrugere, deși este nevoie de mai multă muncă pentru a verifica și înțelege acest mecanism. Deoarece mecanismul celular care degradează proteinele din celulele umane și cel de la șoareci diferă, echipa a folosit și abordarea lor pentru a dezvolta un degron care se leagă de cereblon găsit în celulele de șoarece, ceea ce ar putea fi util în studiile care implică modele de șoareci transgenici ale bolilor umane. /p> Platforma ar putea fi folosită și pentru a dezvolta complexe de lipici moleculari cu noi degroni sau alte combinații de proteine care interacționează în moduri noi și interesante. Cercetătorii lucrează deja cu oameni de știință în cancer biologie și alte domenii pentru a valorifica degronii lor evoluați pentru a marca proteinele de potențial interes terapeutic. Această abordare le permite să elimine o proteină țintă în câteva minute prin adăugarea de PT-179, păstrând în același timp contextul genomic natural al genei corespunzătoare, reducând astfel la minimum perturbarea mecanismelor de reglare esențiale pentru funcția biologică nativă a multor proteine.
Linkul direct catre PetitieCitiți și cele mai căutate articole de pe Fluierul:
|
|
|
Comentarii:
Adauga Comentariu