|
| Fluxul de Stiri dupa Data Aparitiei |
|
Comentarii Adauga Comentariu _ Cercetătorii observă eterogenitatea structurală a unei scramblaze lipidice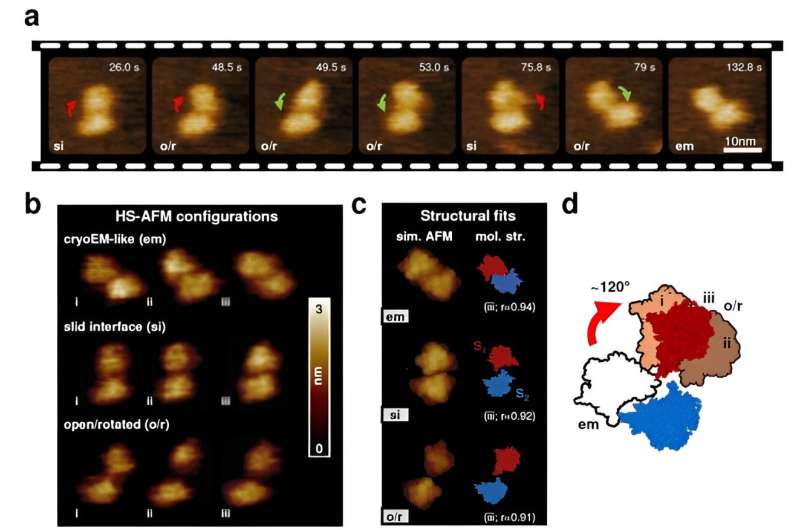 _ Cercetătorii observă eterogenitatea structurală a un scramblase lipidicCercetătorii de la Nano Life Science Institute (WPI-NanoLSI), Universitatea Kanazawa raportează în Nature Communications că TMEM16F, o proteină transmembranară care facilitează mișcarea pasivă a fosfolipidelor și ionilor prin membrane, explorează o formă conformațională mai mare. peisaj decât s-a crezut anterior pentru a-și îndeplini funcțiile unice. Descoperirea ne rafinează înțelegerea moleculară a proceselor fiziologice cruciale, cum ar fi coagularea sângelui și patogeneza COVID-19, și evidențiază importanța sondajului proteinelor membranei în organismele native. ca mediile. Scramblasele lipidice sunt proteine încorporate în membranele celulare care joacă un rol crucial în amestecarea fosfolipidelor între cele două straturi lipidice care formează astfel de granițe celulare. TMEM16F, un membru al familiei de proteine TMEM16, acționează atât ca un canal ionic activat de calciu, cât și ca un scramblază lipidic, ceea ce înseamnă că poate facilita transferul atât al lipidelor, cât și al ionilor în mediul chimic din exteriorul și interiorul celulei. Aceste mișcări reglează mai multe funcții biologice, cum ar fi coagularea sângelui, dezvoltarea oaselor și intrarea virală și, prin urmare, sunt de mare interes fiziologic și clinic. La nivel molecular, arhitectura TMEM16F are o formă cu dublu cilindru în care două lanțuri polipeptidice identice (numite subunități), fiecare formată din 10 elice transmembranare (TM), se lipesc împreună (un proces cunoscut sub numele de dimerizare) pentru a forma două separate și probabil. căi independente ale ionilor și ale lipidelor. Anterior, se credea că TMEM16F ar putea funcționa ca o simplă poartă, ionii de calciu servind drept chei pentru a debloca cele două căi de permeație. Deschiderea și închiderea porții în diferite măsuri ar permite lipidelor și ionilor să traverseze alternativ membrana plasmatică. Cu toate acestea, investigațiile structurale folosind microscopia crio-electronică (cryo-EM) - o tehnică in vitro care poate dezvălui 3D arhitectura proteinelor purificate și congelate la rezoluție aproape atomică — au capturat în mare parte instantanee TMEM16F în conformații inactive, cu porțile ionice și lipidice probabil prinse într-o stare închisă, ridicând semne de întrebare cu privire la validitatea modelelor existente. Pentru o mai bună înțelegere a structurii și a relației funcționale a TMEM16F, Holger Flechsig și Clemens Franz de la WPI-NanoLSI, Universitatea Kanazawa, în colaborare cu Vincent Torre de la Școala Internațională de Studii Avansate (Italia) și foștii membri WPI-NanoLSI Leonardo Puppulin și Arin Marchesi, a folosit tehnici avansate, cum ar fi spectroscopia de forță cu o singură moleculă (SMFS) și imagistica cu microscopie de forță atomică de mare viteză (HS-AFM). Aceste metode le-au permis să observe comportamentul TMEM16F la nivel molecular în medii fiziologice, oferind perspective asupra structurii, dinamicii și proprietăților sale mecanice. Studiul a descoperit că TMEM16F prezintă o gamă largă de conformații structurale care au fost trecute cu vederea până acum. Cercetarea a relevat schimbări neașteptate în interfața de dimerizare și aranjamentele subunităților TMEM16F, sugerând că TMEM16F funcționează într-o manieră mai dinamică și mai versatilă decât se credea anterior. Autorii propun că aceste variații structurale mari sunt critice pentru diversele funcții ale TMEM16F. , inclusiv amestecarea lipidelor și mișcarea ionilor prin membrana celulară. Mai mult, cercetătorii au descoperit că legarea calciului duce la rearanjamente semnificative în regiuni specifice ale proteinei, în special în elicele transmembranare TM3, TM4 și TM6, ceea ce poate duce la deschiderea căilor ionilor și lipidelor. În general, cercetarea extinde studiile structurale anterioare, demonstrează complexitatea relației structura-funcție a TMEM16F și evidențiază importanța probei proteinelor membranare în medii asemănătoare native. Înțelegerea acestor nuanțe structurale ar putea deschide calea pentru terapii și intervenții direcționate pentru a modula activitatea TMEM16F în diferite boli și condiții fiziologice.
Linkul direct catre PetitieCitiți și cele mai căutate articole de pe Fluierul:
|
|
|
Comentarii:
Adauga Comentariu